Евразийский патент на изобретение №013977 "Способ определения в таблетке количества активных компонентов в виде аминокислот глицина, L-глутаминовой кислоты и L-цистина"
Патентообладатель: НЕКОММЕРЧЕСКОЕ УЧРЕЖДЕНИЕ "НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ЦИТОХИМИИ И МОЛЕКУЛЯРНОЙ ФАРМАКОЛОГИИ"; Авторы: Комиссарова Ирина Алексеевна, Нарциссов Ярослав Рюрикович, Волченкова Татьяна Александровна; Международная патентная классификация: G01N 30/88 (2006.01); Дата подачи заявки: 18.12.2009; Дата публикации сведений о выдаче патента (выдача патента): 30.08.2010.
Способ определения в таблетке количества активных компонентов
в виде аминокислот глицина, L-глутаминовой кислоты и L-цистина
Описание изобретение к евразийскому патенту
Область применения
Изобретение относится к фармацевтической промышленности, а конкретно к способу определения в таблетке количества активных компонентов в виде аминокислот: глицина, L глутаминовой кислоты и L цистина.
Уровень техники
Исследования лекарственных возможностей композиции аминокислот L-цистина, L-глутаминовой кислоты и глицина проводятся достаточно давно. Известен препарат, включающий аминокислоты: L-цистин, L-глутаминовую кислоту и глицин при массовом соотношении компонентов 1:1:1 и при количественном содержании 0,1 г для каждого компонента, который используется в качестве средства, индуцирующего биосинтез глутатиона, активность глутатионтрансферазы и оказывающего антитоксическое, радиопротекторное и антигипоксическое действие (RU 2096034 C1, МПК 6 A61K 31/195, 1997).
При производстве такого лекарственного препарата или аналогичного, включающего равные доли аминокислот L-цистина, L-глутаминовой кислоты и глицина в большем или меньшем количестве, необходим надежный и простой метод контроля лекарственного препарата, предусматривающий качественное и количественное определение перечисленных аминокислот.
Известен способ качественного и количественного определения аминокислот с использованием высокоэффективной жидкостной хроматографии, при котором хроматографическое определение производится с использованием предварительно полученных флуоресцентных N
2-бензоксазолил производных аминокислот.
Этот известный способ не позволяет с достаточной степенью точности определить все входящие в препарат, представляющий собой таблетку, аминокислоты, в частности глицин и L-глутаминовую кислоту, пики которых на хроматограммах при недостаточном времени удерживания могут пересекаться, чему дополнительно способствуют наряду с свойствами этих аминоскислот входящие в таблетку вспомогательные вещества, а также равная концентрация аминокислот.
Сущность изобретения
Задача изобретения заключается в надежном качественном и количественном определении за короткий промежуток времени за один анализ при простой пробоподготовке входящих в общую композицию таблетки в равных долях трех аминокислот: L-цистина, L-глутаминовой кислоты и глицина.
Эту задачу решает способ определения в таблетке количества активных компонентов в виде аминокислот: глицина, L глутаминовой кислоты и L цистина, который включает последовательное выполнение следующих операций:
- приготовление в водном растворе натрия карбоната стандартного раствора аминокислот глицина, L глутаминовой кислоты и L цистина и испытуемого раствора таблеток, включающих перечисленные аминокислоты в равных долях, из порошка таблеток;
- приготовление растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток введением в стандартный раствор и в испытуемый раствор аминокислот избыточного количества модифицирующего реагента, приготовленного растворением п-толуолсульфохлорида в ацетонитриле (ПТСХ), а затем введением стоп-реагента в виде раствора ортофосфорной кислоты;
- проведение высокоэффективной жидкостной хроматографии растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток с использованием в качестве мобильной фазы водного раствора калия фосфата однозамещенного с ацетонитрилом;
- осуществление идентификации аминокислот на полученных хроматограммах по времени удерживания стандартного раствора и испытуемого раствора с определением площадей пиков аминокислот;
- расчет содержания каждой аминокислоты в таблетке по определенным площадям пиков аминокислот в стандартном растворе аминокислот и в испытуемом растворе таблеток, а также по величинам навесок аминокислот в стандартном растворе аминокислот, навески порошка таблеток в испытуемом растворе таблеток и по величине массы таблетки.
Для большей точности определения аминокислот глицина, L глутаминовой кислоты и L-цистина возможно проведение идентификации модифицирующего реагента на полученных хроматограммах с определением площадей соответствующих ему пиков, а расчета содержания каждой аминокислоты в таблетке проводить с введением поправки на величину отношения площадей пиков модифицирующего реагента в стандартном растворе аминокислот и в испытуемом растворе таблеток.
Модифицирующий реагент, приготовленный растворением п толуолсульфохлорида в ацетонитриле, удобный в работе, является своеобразным внутренним стандартом. Контроль над полнотой прохождения реакции дериватизации (получения тозил-производных аминокислот) в каждой отдельной пробирке – это важный момент, так как мы имеем дело с гетерофазной реакцией, на которую влияет множество факторов: температура внешней среды (реакция идет при комнатной температуре), концентрация реагентов, рН содового раствора (0,2 М раствор натрия карбоната) и его диссоциация; кроме того при добавлении раствора ортофосфорной кислоты («стоп-реагента») происходит выделение газа, а следовательно, изменяется объем реакционной смеси, что также влияет на точность определения содержания аминокислот в препарате. П-толуолсульфохлорид не является по своей природе высокоспецифичным модифицирующим (дериватизирующим) агентом, так как может взаимодействовать не только с NH
2- группой аминокислот и функциональной группой аминов (первичных и вторичных с образованием сульфамидных соединений), но и с гидроксильной OH- группой или карбоксильной СООН- группой. ОН- группы образующиеся при диссоциации 0,2 М водного раствора натрия карбоната могут вступать в неконтролируемую реакцию с ПТСХ, и несмотря на то, что ПТСХ взят в избытке (минимум 13-кратный избыток по отношению к модифицируемому веществу) для проведения реакции дериватизации, изобретение позволяет с достаточной степенью точности осуществлять расчет количественного содержания каждой аминокислоты в лекарственном препарате. В частности по причине контролируемого прохождения реакций дериватизации аминокислот перед их количественным определением.
В предпочтительном варианте осуществления изобретения, когда характеристики высокоэффективной жидкостной хроматографии лежат для стандартных растворов аминокислот и испытуемых растворов препарата в интервалах по времени выхода пиков менее 2 %, по площади пиков – менее 10 % , а пробоподготовка стандартных растворов аминокислот и испытуемых растворов препарата четко отработана, хроматографический анализ может выполняться для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток. При этом расчет содержания каждой аминокислоты в таблетке в мг проводится по формуле:

Если характеристики высокоэффективной жидкостной хроматографии не удовлетворяют указанным выше условиям, то хроматографический анализ выполняется также для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток, но расчет содержания каждой аминокислоты в таблетке в мг в этом случае проводят по формуле:

Поправка S
ПТСХ ст / S
ПТСХ i может быть введена в расчет благодаря использованию избыточного количества модифицирующего реагента, обеспечивающего контролируемое прохождение реакций дериватизации аминокислот перед их количественным определением.
При осуществлении изобретения предпочтительно использовать 0,2 М водный раствор натрия карбоната.
Стандартный раствор аминокислот предпочтительно приготавливать растворением навесок по 10,0- 15,0 мг каждой из аминокислот L-цистина, L глутаминовой кислоты и глицина в 100 – 150 мл раствора натрия карбоната при перемешивании с последующим доведением объема раствора до 250 мл и его фильтрацией.
Испытуемый раствор таблеток предпочтительно приготавливать измельчением, по меньшей мере, трех таблеток и растворением навески в 35,0 – 40,0 мг. полученного порошка в 100-150 мл раствора натрия карбоната с последующим доведением объема раствора до 250 мл и его фильтрацией.
Приготовление модифицирующего реагента в наилучшем варианте реализации изобретения осуществляют растворением 15,0 мг п-толуолсульфохлорида в 1,0 мл ацетонитрила с последующим встряхиванием со скоростью 1500 об/мин. в течение 2 мин.
Приготовление растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток в наилучшем варианте реализации изобретения осуществляют добавлением по 50 мкл раствора модифицирующего реагента в 200 мкл, стандартного раствора аминокислот и в 200 мкл испытуемого раствора таблеток с последующим их встряхиванием со скоростью 1500 об/мин в течение 30 секунд и выдерживанием 30 минут при комнатной температуре, после чего в реакционные смеси добавляют по 25 мкл стоп-реагента в виде 42,5% раствора ортофосфорной кислоты, а затем вновь встряхивают со скоростью 1500 об/мин. до окончания выделения углекислого газа в течение 0,45 – 1,5 мин.
Мобильная фаза для высокоэффективной жидкостной хроматографии может быть приготовлена растворением 7,0 г калия фосфата однозамещенного в 700 мл воды, после чего pH раствора доводят добавлением концентрированной ортофосфорной кислоты до значения 2,8, затем раствор перемешивают, добавляют 250 мл ацетонитрила, а затем объем раствора доводят водой до 1000 мл и фильтруют.
В предпочтительном варианте осуществления изобретения в хроматограф вводят аликвоты по 40 мкл стандартного раствора аминокислот или испытуемого раствора таблеток, при этом хроматографию проводят с использованием колонки 150×4,6 мм в течение 8 мин в изократическом режиме при температуре колонки 50
оС, объеме инжектора: 20 мкл и скорости потока элюента 1 мл/мин.
Пример осуществления изобретения
Осуществления изобретения поясняет примером количественного определения аминокислот: глицина, L-глутаминовой кислоты и L-цистина в лекарственном препарате в форме таблетки, содержащей каждой из перечисленных аминокислот в количестве 70 мг.
Вначале приготавливают растворы, необходимые для реализации способа, которые используют свежеприготовленными.
Для приготовления 0,2 М раствора натрия карбоната в мерной колбе вместимостью 1000 мл растворяют 21,2 г натрия карбоната в 700 мл воды очищенной на магнитной мешалке, доводят водой очищенной до метки и перемешивают.
Для приготовления стандартного раствора аминокислот навески L-цистина – 12,0 мг, L-глутаминовой кислоты – 12,0 мг, глицина – 12,0 мг помещают в мерную колбу вместимостью 250 мл, растворяют в 100 мл ранее приготовленного 0,2 М раствора натрия карбоната при перемешивании в течение 20 минут на магнитной мешалке и доводят до метки 0,2 М раствором натрия карбоната, после чего раствор фильтруют через беззольный фильтр.
Для приготовление испытуемого раствора лекарственного препарата три таблетки растирают в фарфоровой ступке, затем навеску 37,5 мг полученного порошка помещают в мерную колбу вместимостью 250 мл, растворяют в 100 мл 0,2 М раствора натрия карбоната при перемешивании в течение 20 мин. на магнитной мешалке и доводят до метки 0,2 М раствором натрия карбоната, после чего раствор также фильтруют через беззольный фильтр.
Для приготовление раствора модифицирующего реагента (ПТСХ) взвешивают 15,0 мг п-толуолсульфохлорида (тозилхлорида), помещают в герметично закрывающуюся коническую пробирку (общий объем 1,7 мл) и растворяют в 1,0 мл ацетонитрила; встряхивают на автоматическом встряхивателе со скоростью 1500 об/мин. в течение 2 мин.
Для приготовление 42,5% раствора ортофосфорной кислоты (стоп-реагента) в мерную колбу вместимостью 50 мл, содержащую 15-20 мл воды очищенной, помещают 25,0 мл концентрированной (85%) ортофосфорной кислоты, доводят водой очищенной до метки и перемешивают. Этот раствор имеет продолжительный срок хранения, до 1 месяца.
Для приготовление мобильной фазы для высокоэффективной жидкостной хроматографии в мерную колбу вместимостью 1000 мл помещают 7,0 г калия фосфата однозамещенного, растворяют в 700 мл воды очищенной на магнитной мешалке, доводят pH добавлением концентрированной ортофосфорной кислоты до значения 2,8, перемешивают, добавляют 250 мл ацетонитрила, доводят водой очищенной до метки, хорошо перемешивают, фильтруют через фильтр 0,45 мкм и дегазируют с помощью вакуумного насоса. Этот раствор также имеет продолжительный срок хранения, до 1 месяца.
После приготовления указанных выше растворов осуществляют получение тозил-производных (дериватизацию) стандартного раствора аминокислот и испытуемого раствора лекарственного препарата.
Для этого механическим дозатором отбирают по 200 мкл стандартного раствора аминокислот для трех параллельных определений и испытуемого раствора препарата также для трех параллельных определений, переносят в конические пробирки, добавляют механическим дозатором по 50 мкл раствора модифицирующего реагента, закрывают крышки и интенсивно встряхивают на автоматическом встряхивателе со скоростью 1500 об/мин. в течение 30 с, а затем выдерживают в течение 30 мин. при комнатной температуре для прохождения реакции.
После этого в реакционные смеси добавляют механическим дозатором по 25 мкл 42,5% раствора ортофосфорной кислоты (стоп-реагент) и снова встряхивают полученные смеси на автоматическом встряхивателе со скоростью 1500 об/мин. до окончания выделения углекислого газа (около 1 мин.).
После окончания процесса модификации (дериватизации) по три параллельных образца стандартных растворов аминокислот и испытуемых растворов препарата должны быть сразу последовательно введены в хроматографическую колонку высокоэффективного жидкостного хроматографа, имеющего программно-аппаратный комплекс для сбора и обработки данных со спектрофотометрическим детектором и аналого-цифровым преобразователем сигнала, совместимым с компьютером. В колонку хроматографа последовательно вводят микрошприцем вместимостью 100 мкл аликвоты (40 мкл) полученных тозил-производных стандартных растворов аминокислот и испытуемых растворов препарата (по три образца).
Хроматографические условия: колонка 150×4,6 мм, мобильная фаза - раствор калия фосфата однозамещенного (0,05 М) / ацетонитрил, изократический режим, температура колонки 500оС, объем инжектора 20 мкл, длина волны 254 нм, скорость потока элюента 1 мл/мин, время анализа 8 мин.
Средние значения характеристик высокоэффективной жидкостной хроматогорафии для стандартных растворов аминокислот и испытуемых растворов препарата должны быть в интервалах: времена выхода пиков – 2 %, площади пиков – 10 %. При больших отклонениях характеристик от заданных анализ повторяют до достижения необходимых параметров. Для обеспечения пригодности хроматографической системы возможно отклонение от указанных выше условий хроматографирования.
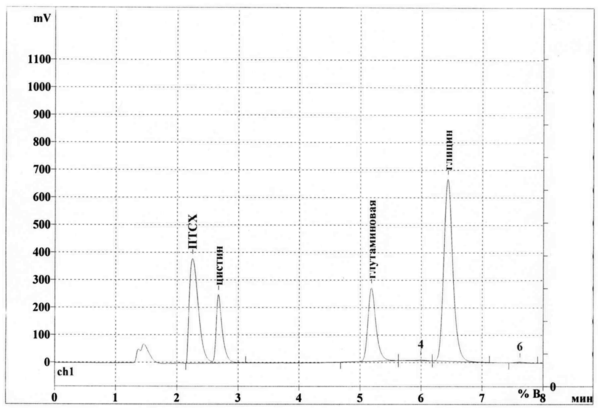
По результатам анализа получают хроматограммы, представленные на иллюстрации в описании, на которых по времени удерживания проводят идентификацию аминокислот и определяют площади пиков, соответствующих каждой аминокислоте, в стандартных растворах аминокислот и в испытуемых растворах препарата.
Расчет содержания каждой аминокислоты в таблетке в мг проводят по средним площадям пиков, исходя из трех параллельных определений, как для стандартного раствора аминокислот, так и для испытуемого раствора препарата по формуле:

Площади пиков и расчет содержания каждой аминокислоты осуществляются программно с использованием компьютера, который, как указано выше, связан с программно-аппаратным комплексом высокоэффективного жидкостного хроматографа.
Если средние значения характеристик хроматографической системы для стандартных растворов аминокислот и испытуемых растворов препарата находятся в интервалах по времени выхода пиков – менее 2 %, по площади пиков – менее 10 % , а пробоподготовка стандартных растворов аминокислот и испытуемых растворов препарата четко отработана (включая соблюдение всех вышеизложенных условий при приготовлении растворов, проведении дериватизации, прерывании прохождения реакции, условий хроматографирования и тому подобное), то расчет содержания каждой аминокислоты в таблетке в мг можно проводят по средним площадям пиков, исходя из трех параллельных определений, как для стандартного раствора аминокислот, так и для испытуемого раствора препарата без учета соотношения площадей пиков модифицирующего реагента в испытуемом и стандартном растворах (в данном случае соотношение близко к единицы и им можно пренебречь) по формуле:

Способ позволяет определить количественное содержание аминокислот в одной таблетке с точностью ±5,3 мг, что соответствует допустимому пределу для таблетки лекарственного препарата, содержащей глицин, L-глутаминовую кислоту и L цистин.
Для количественного определения аминокислот глицина, L-глутаминовой кислоты и L-цистина в лекарственном препарате в форме таблетки, содержащей каждой из перечисленных аминокислот в количестве 90 мг, способ реализуется с теми же параметрами.
Формула изобретения
1. Способ определения в таблетке количества активных компонентов в виде аминокислот глицина, L глутаминовой кислоты и L цистина, включающий последовательное выполнение
приготовления в водном растворе натрия карбоната стандартного раствора аминокислот глицина, L глутаминовой кислоты и L цистина и испытуемого раствора таблеток из порошка таблеток,
приготовления растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток введением в стандартный раствор и в испытуемый раствор аминокислот избыточного количества модифицирующего реагента, приготовленного растворением п-толуолсульфохлорида в ацетонитриле, а затем введением стоп-реагента в виде раствора ортофосфорной кислоты,
высокоэффективной жидкостной хроматографии растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток с использованием в качестве мобильной фазы водного раствора калия фосфата однозамещенного с ацетонитрилом,
идентификации аминокислот на полученных хроматограммах по времени удерживания стандартного раствора и испытуемого раствора с определением площадей пиков аминокислот,
расчета содержания каждой аминокислоты в таблетке по определенным площадям пиков аминокислот в стандартном растворе аминокислот и в испытуемом растворе таблеток, а также по величинам навесок аминокислот в стандартном растворе аминокислот, навески порошка таблеток в испытуемом растворе таблеток и по величине массы таблетки
2. Способ по п.1, отличающийся тем, что проводят идентификацию модифицирующего реагента на полученных хроматограммах с определением площадей соответствующих ему пиков, а расчета содержания каждой аминокислоты в таблетке осуществляют с введением поправки на величину отношения площадей пиков модифицирующего реагента в стандартном растворе аминокислот и в испытуемом растворе таблеток.
3. Способ по п.1, отличающийся тем, что выполняют хроматографический анализ для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток, а расчета содержания каждой аминокислоты в таблетке в мг проводят по формуле:

4. Способ по п.2, отличающийся тем, что выполняют хроматографический анализ для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток, а расчет содержания каждой аминокислоты в таблетке в мг проводят по формуле:

5. Способ по п.1, отличающийся тем, что используют 0,2 М водный раствор натрия карбоната.
6. Способ по п.1, отличающийся тем, что стандартный раствор аминокислот получают растворением навесок по 10,0 - 20,0 мг каждой из аминокислот L-цистина, L глутаминовой кислоты и глицина в 100 – 150 мл раствора натрия карбоната при перемешивании с последующим доведением объема раствора до 250 – 300 мл и его фильтрацией.
7. Способ по п.1, отличающийся тем, что испытуемый раствор таблеток получают измельчением, по меньшей мере, трех таблеток и растворением навески в 35,0 – 45,0 мг. полученного порошка в 100 - 150 мл раствора натрия карбоната с последующим доведением объема раствора до 250 – 300 мл и его фильтрацией.
8. Способ по п.1, отличающийся тем, что приготовление модифицирующего реагента осуществляют растворением 15,0 мг п-толуолсульфохлорида в 1,0 мл ацетонитрила с последующим встряхиванием со скоростью 1500 об/мин. в течение 2 мин.
9. Способ по п.1, отличающийся тем, что приготовление растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток осуществляют добавлением по 50 мкл раствора модифицирующего реагента в 200 мкл, стандартного раствора аминокислот и в 200 мкл испытуемого раствора таблеток с последующим их встряхиванием со скоростью 1500 об/мин в течение 30 секунд и выдерживанием 30 минут при комнатной температуре, после чего в реакционные смеси добавляют по 25 мкл стоп-реагента в виде 42,5% раствора ортофосфорной кислоты, а затем вновь встряхивают со скоростью 1500 об/мин. до окончания выделения углекислого газа в течение 0,45 – 1,5 мин.
10. Способ по п.1, отличающийся тем, что приготовление мобильной фазы для высокоэффективной жидкостной хроматографии осуществляют растворением 7,0 г калия фосфата однозамещенного в 700 мл воды, после чего pH раствора доводят добавлением концентрированной ортофосфорной кислоты до значения 2,8, затем раствор перемешивают, добавляют 250 мл ацетонитрила, после чего объем раствора доводят водой до 1000 мл и фильтруют.
11. Способ по п.1, отличающийся тем, что в хроматограф вводят аликвоты по 40 мкл стандартного раствора аминокислот или испытуемого раствора таблеток, при этом хроматографию проводят с использованием колонки 150×4,6 мм в течение 8 мин в изократическом режиме при температуре колонки 50
оС, объеме инжектора: 20 мкл и скорости потока элюента 1 мл/мин.
Реферат
Задача изобретения заключается в надежном качественном и количественном определении за короткий промежуток времени за один анализ при простой пробоподготовке входящих в общую композицию таблетки в равных долях трех аминокислот L-цистина, L-глутаминовой кислоты и глицина. Способ включает последовательное выполнение: приготовления в водном растворе натрия карбоната стандартного раствора аминокислот глицина, L глутаминовой кислоты и L цистина и испытуемого раствора таблеток, включающих перечисленные аминокислоты в равных долях, из порошка таблеток; приготовления растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток введением в стандартный раствор и в испытуемый раствор аминокислот избыточного количества модифицирующего реагента, приготовленного растворением п-толуолсульфохлорида в ацетонитриле, а затем введением стоп-реагента в виде раствора ортофосфорной кислоты; проведения высокоэффективной жидкостной хроматографии растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток с использованием в качестве мобильной фазы водного раствора калия фосфата однозамещенного с ацетонитрилом; осуществление идентификации аминокислот на полученных хроматограммах по времени удерживания стандартного раствора и испытуемого раствора с определением площадей пиков аминокислот; расчет содержания каждой аминокислоты в таблетке по определенным площадям пиков аминокислот в стандартном растворе аминокислот и в испытуемом растворе таблеток, а также по величинам навесок аминокислот в стандартном растворе аминокислот, навески порошка таблеток в испытуемом растворе таблеток и по величине массы таблетки. 10 з.п. ф-лы, 1 ил.
Графические материалы
 30+
30+
 Если характеристики высокоэффективной жидкостной хроматографии не удовлетворяют указанным выше условиям, то хроматографический анализ выполняется также для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток, но расчет содержания каждой аминокислоты в таблетке в мг в этом случае проводят по формуле:
Если характеристики высокоэффективной жидкостной хроматографии не удовлетворяют указанным выше условиям, то хроматографический анализ выполняется также для трех порций стандартного раствора аминокислот и для трех порций испытуемого раствора таблеток, но расчет содержания каждой аминокислоты в таблетке в мг в этом случае проводят по формуле:
 Поправка SПТСХ ст / SПТСХ i может быть введена в расчет благодаря использованию избыточного количества модифицирующего реагента, обеспечивающего контролируемое прохождение реакций дериватизации аминокислот перед их количественным определением.
При осуществлении изобретения предпочтительно использовать 0,2 М водный раствор натрия карбоната.
Стандартный раствор аминокислот предпочтительно приготавливать растворением навесок по 10,0- 15,0 мг каждой из аминокислот L-цистина, L глутаминовой кислоты и глицина в 100 – 150 мл раствора натрия карбоната при перемешивании с последующим доведением объема раствора до 250 мл и его фильтрацией.
Испытуемый раствор таблеток предпочтительно приготавливать измельчением, по меньшей мере, трех таблеток и растворением навески в 35,0 – 40,0 мг. полученного порошка в 100-150 мл раствора натрия карбоната с последующим доведением объема раствора до 250 мл и его фильтрацией.
Приготовление модифицирующего реагента в наилучшем варианте реализации изобретения осуществляют растворением 15,0 мг п-толуолсульфохлорида в 1,0 мл ацетонитрила с последующим встряхиванием со скоростью 1500 об/мин. в течение 2 мин.
Приготовление растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток в наилучшем варианте реализации изобретения осуществляют добавлением по 50 мкл раствора модифицирующего реагента в 200 мкл, стандартного раствора аминокислот и в 200 мкл испытуемого раствора таблеток с последующим их встряхиванием со скоростью 1500 об/мин в течение 30 секунд и выдерживанием 30 минут при комнатной температуре, после чего в реакционные смеси добавляют по 25 мкл стоп-реагента в виде 42,5% раствора ортофосфорной кислоты, а затем вновь встряхивают со скоростью 1500 об/мин. до окончания выделения углекислого газа в течение 0,45 – 1,5 мин.
Мобильная фаза для высокоэффективной жидкостной хроматографии может быть приготовлена растворением 7,0 г калия фосфата однозамещенного в 700 мл воды, после чего pH раствора доводят добавлением концентрированной ортофосфорной кислоты до значения 2,8, затем раствор перемешивают, добавляют 250 мл ацетонитрила, а затем объем раствора доводят водой до 1000 мл и фильтруют.
В предпочтительном варианте осуществления изобретения в хроматограф вводят аликвоты по 40 мкл стандартного раствора аминокислот или испытуемого раствора таблеток, при этом хроматографию проводят с использованием колонки 150×4,6 мм в течение 8 мин в изократическом режиме при температуре колонки 50оС, объеме инжектора: 20 мкл и скорости потока элюента 1 мл/мин.
Поправка SПТСХ ст / SПТСХ i может быть введена в расчет благодаря использованию избыточного количества модифицирующего реагента, обеспечивающего контролируемое прохождение реакций дериватизации аминокислот перед их количественным определением.
При осуществлении изобретения предпочтительно использовать 0,2 М водный раствор натрия карбоната.
Стандартный раствор аминокислот предпочтительно приготавливать растворением навесок по 10,0- 15,0 мг каждой из аминокислот L-цистина, L глутаминовой кислоты и глицина в 100 – 150 мл раствора натрия карбоната при перемешивании с последующим доведением объема раствора до 250 мл и его фильтрацией.
Испытуемый раствор таблеток предпочтительно приготавливать измельчением, по меньшей мере, трех таблеток и растворением навески в 35,0 – 40,0 мг. полученного порошка в 100-150 мл раствора натрия карбоната с последующим доведением объема раствора до 250 мл и его фильтрацией.
Приготовление модифицирующего реагента в наилучшем варианте реализации изобретения осуществляют растворением 15,0 мг п-толуолсульфохлорида в 1,0 мл ацетонитрила с последующим встряхиванием со скоростью 1500 об/мин. в течение 2 мин.
Приготовление растворов тозил-производных стандартного раствора аминокислот и испытуемого раствора таблеток в наилучшем варианте реализации изобретения осуществляют добавлением по 50 мкл раствора модифицирующего реагента в 200 мкл, стандартного раствора аминокислот и в 200 мкл испытуемого раствора таблеток с последующим их встряхиванием со скоростью 1500 об/мин в течение 30 секунд и выдерживанием 30 минут при комнатной температуре, после чего в реакционные смеси добавляют по 25 мкл стоп-реагента в виде 42,5% раствора ортофосфорной кислоты, а затем вновь встряхивают со скоростью 1500 об/мин. до окончания выделения углекислого газа в течение 0,45 – 1,5 мин.
Мобильная фаза для высокоэффективной жидкостной хроматографии может быть приготовлена растворением 7,0 г калия фосфата однозамещенного в 700 мл воды, после чего pH раствора доводят добавлением концентрированной ортофосфорной кислоты до значения 2,8, затем раствор перемешивают, добавляют 250 мл ацетонитрила, а затем объем раствора доводят водой до 1000 мл и фильтруют.
В предпочтительном варианте осуществления изобретения в хроматограф вводят аликвоты по 40 мкл стандартного раствора аминокислот или испытуемого раствора таблеток, при этом хроматографию проводят с использованием колонки 150×4,6 мм в течение 8 мин в изократическом режиме при температуре колонки 50оС, объеме инжектора: 20 мкл и скорости потока элюента 1 мл/мин.