Патент РФ на изобретение № 2321601 "Разветвленные полифенилены и способ их получения"
Патентообладатель: Общество с ограниченной ответственностью "МИРКОН"; Авторы: Хотина Ирина Анатольевна, Кушакова Наталия Сергеевна, Рудь Дмитрий Алексеевич, Витухновский Алексей Григорьевич; Международная патентная классификация: C08G 61/10 (2006.01); Дата подачи заявки: 07.06.2006; Дата публикации сведений о выдаче патента (выдача патента): 10.04.2008.
Описание изобретения
Изобретение относится к химической и электронной отраслям промышленности, а конкретно к разветвленным полифениленам и способу их получения. Изобретение может быть использовано при производстве дисплеев, в электрофотографии, при изготовлении осветительных источников, фотодетекторов, сенсоров, полевых транзисторов, диодных лазеров и в других областях, когда необходимо обеспечить люминесценцию при преобразовании электрической энергии в световую.
Одним из направлений конструирования дисплеев является использование органических материалов для светоизлучающих диодов (OLED), которые значительно более дешевы, чем на основе неорганических. Особый интерес представляют материалы, излучающие свет в синей и фиолетовой области, и их круг ограничен фениленовыми структурами. К ним относятся полифенилены, разветвленные звездообразные полифенилены, полиариленэтинилены, а также разветвленные большие молекулы, такие как фениленовые дендримеры.
Известны сшитые полифенилены следующей общей формулы
Эти полифенилены получают на основе диэтинильных ароматических соединений или смеси диэтинильных ароматических и моноэтинильных ароматических или алифатических соединений в присутствии металлокомплексов как катализаторов при температурах до 200
оС (US №3705131, МПК 2 C08F 9/00, 1972; GB №1337740, МПК 2 C08F 9/00, 1973).
Сложность и нетехнологичность известного способа обусловлена синтезом этинильных соединений и применением специфических металлокомплексных катализаторов, синтез которых также затруднен. Кроме того, известный метод не позволяет получить светоизлучающие материалы, вследствие тушения люминесценции металлокомплексом, остающимся в полимере после выделения.
Нерастворимость полимера затрудняет его переработку, в частности, не позволяет наносить полимер на подложку в виде раствора, однако, в случае получения полимера непосредственно на подложке в тонком слое, в результате напыления компонентов и их последующей полимеризации, полимерные сшивки также способствуют тушению люминесценции.
Известен более простой способ получения аналогичных структур, растворимых полифениленов общей формулы

,
R
1 и R
2 – ароматические группы.
В соответствии с этим известным способом полифенилены получают на основе доступных моно- и диацетилароматических соединений или их этилкеталей в растворе, в присутствии кислотных катализаторов, например п-толуолсульфокислоты или газообразного хлористого водорода, при комнатной температуре (US №4064097, МПК 3 C08L 65/02, 1977; SU №302022, МПК 6 C08G61/10, 1972).
Однако дефектные фрагменты дипнонового типа, а также концевые ацетильные или кетальные группы полностью исключают люминесценцию таких полимеров.
Технический результат изобретения заключается в получении разветвленных полифениленов с использованием реакций, которые приводят к полимерным структурам, лишенным химических дефектов, тушащих люминесценцию. Разветвленность структуры обеспечивает растворимость, то есть перерабатываемость полимерного материала, что является необходимым условием его применения в OLED. Полимеры обладают эффективной люминесценцией с широком диапазоне видимого спектра, в том числе в сине-фиолетовой области и могут быть применены в качестве активных слоев светоизлучающих диодов.
Для решения поставленной задачи используют полифенилены следующей общей формулы:

,
где
n – степень полимеризации от 5 до 20;
m = 1, 2;
q = 1, 2;
Ar – ариленовая группа, карбоксинафтильная группа, нафтилимидная, нафтильная, антраценовая группы, гетероциклическая группа, в том числе пиридильная и бипиридильная.
Способ получения полифениленов указанной выше общей формулы заключается в проведении полимеробразующей реакции кросс-сочетания бром-замещенных ароматических или гетероароматических соединений или реакции бром-замещенных и борокси- или пинаколборат-замещенных ароматических или гетероароматических соединений в присутствии комплексов никеля или палладия, в которой в качестве исходных и одновременно разветвляющих мономеров применяются 1,3,5-три(п-бромфенил)бензол или 1,3,5-три(п-бромдифенил)бензол.
Материалы исследованы с точки зрения оптических свойств, в первую очередь, люминесценции. Определено, что данные вещества, обладают эффективной флюоресценцией в синей области спектра при 370 – 410 нм и также обладают высокими относительными квантовыми выходами флуоресценции в диапазоне от 50 до 94%. Предварительные исследования показали значительную электролюминесценцию пленок полимеров в данном спектральном диапазоне.
Возможность осуществления изобретения подтверждается следующими примерами синтеза.
Пример 1. Получение полимера из 1,3,5-три(п-бромфенил)бензола (мономер 1) с катализатором Ni(0) (m = 1; q = 2) в соответствии с реакцией, протекающей по следующей схеме.

,
где

,

Предварительно проводят синтез разветвляющего мономера - 1,3,5- три(п-бромофенил)бензола (1).
При комнатной температуре в 500 мл колбу загрузили 60 г (0,3 моль) п-бромацетофенона, 60 мл (0,36 моль) ортомуравьиного эфира и 50 мл бензола и в течение трех часов пропускали через этот раствор газообразный HCI. Спустя один час раствор становится буро-красного цвета и выпадет осадок.
Полученный осадок отфильтровывали, промывали ацетоном, пока розовый осадок не стал белым, и сушили в вакууме. Выход составил 29% (2,6 г).
Перегоняют диметилформамид (ДМФА) в среде аргона в присутствии гидрида кальция. Ткип ДМФА = 153оС. Безводный NiCl
2 (0,026 г, 0,0002 моль), Ph
3P (0,112 г, 0,0004 моль), бипиридил (0,032 г, 0,0002 моль), 4-бромбензол (0,67 г, 4,25 моль) и 1,3,5-три(п-бромфенил)бензол (1) (2,3 г, 0,0043 моль) помещают в пробирку Шленка заполненную аргоном. Пробирку вакуумируют и заполняют аргоном (5 раз). Затем в нее добавляют сухой ДМФА (1 мл).
Реакционную смесь быстро нагревают до 90
оС и затем перемешивают при этой температуре в течение 6 часов. В первые 10 минут реакционная масса становится красно-коричневой, что свидетельствует об образовании каталитического комплекса. Конечный раствор высаживают в метанол, собирают осадок, промывают его раствором HCl, водой, метанолом, и высушивают в вакуумном эксикаторе при комнатной температуре в течение 10 часов. Выход составляет 76% (1,7 г).
Пример 2. Получение полимера из 1,3,5- три(п-бромдифенил)бензола (мономер 2) и фенилендиборной кислоты с катализатором Pd(0) в соответствии с реакцией, протекающей по следующей схеме.

,
где Ar – в соответствии с примером 1,

Предварительно осуществляют синтез мономера - 1,3,5- три(п-бромдифенил)бензола (2).
При комнатной температуре в 200 мл колбу загрузили 10 г (0,036 моль) бромацетофенона, 21,5 мл (0,13 моль) ортомуравьиного эфира и 25 мл бензола и в течение трех часов пропускали через этот раствор газообразный HCI. Спустя один час, раствор становится буро-красного цвета и выпадет осадок.
Полученный осадок отфильтровывали, промывали ацетоном, пока розовый осадок не стал белым, и сушили в вакууме. Выход составил 42% (3,9 г).
Перегнали растворители непосредственно перед синтезом в среде аргона.
В пробирку Шленка, продутую сухим аргоном, загружали исходные продукты в токе аргона: 0,5 г (0,003 моль) фенилдиборной кислоты, 0,9 г (0,001656 моль) 1,3,5- три(п-бромофенил)бензола и 0.375 г (0,00135 моль) 4-бром-1,8-нафталевого ангидрида, добавили ДМФА и катализатор – тетра-кис-трифенилфосфин палладий, 25 мг тетрабутиламмоний хлористый, подогревали до полного растворения исходных веществ.
При слабом нагреве произошло растворение, а при увеличении температуры масса стала ярко – оранжевая. Реакционную массу нагревали до 80
оС и перемешивали при этой температуре в течение 2 часов.
Раствор высадили в метанол и образовавшийся осадок отфильтровали. Осадок промывали раствором HCl, водой, метанолом, и высушивали в вакуумном эксикаторе при комнатной температуре в течение 10 часов. Выход составил 65% (0,7 г).
Пример 3. Получение полимера из 1,3-ди(п-бороксифенил),5-(п-бромфенил)бензол (мономер 3) с катализатором Pd(0) в соответствии с реакцией, протекающей по следующей схеме.

,
Ar– – в соответствии с примером 1,

Предварительно осуществляют получение 1,3-ди(п-бороксифенил),5-(п-бромфенил)бензола (мономер 3).
К раствору 3 г (0,0055 моль) мономера 1 (1,3,5-три(п-бромфенил)бензол) в ТГФ (100 мл) при температуре -78
оС и перемешивании добавляют 6,64 мл 2,5М раствора н-бутиллития в гексане в течение 30 мин. Реакционную массу перемешивают в течение 6 часов при этой же температуре и затем добавляют 4,1 мл (53 ммоль) триметилбората. Смесь нагревают до комнатной температуры, разбавляют хлороформом, промывают водой и сушат. Затем смесь разделяют на хроматографической колонке с силикагелем, элюэнт – хлороформ. Выход – 42%. Далее, в пробирку Шленка, заполненную аргоном, помещают 1,3-ди(п-бороксифенил),5-(п-бромфенил)бензола (мономер 3) (1,8 г, 0,0043 моль). Пробирку вакуумируют и заполняют аргоном (5 раз). Затем в нее добавляют сухой ДМФА (1 мл), катализатор – тетра-кис-трифенилфосфин палладий, 25 мг тетрабутиламмония хлористого. Реакционную смесь быстро нагревают до 90
оС и затем перемешивают при этой температуре в течение 1 часа. Затем в пробирку добавляют бромбензол (0,67 г, 0,0043 моль) и нагревают при этой же температуре в течение 5 часов.
Конечный раствор высаживают в метанол, собирают осадок, промывают его раствором HCl, водой, метанолом, и высушивают в вакуумном эксикаторе при комнатной температуре в течение 10 часов. Выход составляет 95% (1,7 г).
Пример 4. Получение полимера из мономера 1 и 1,3,5-три(п-фенилпинаколборат)бензола (мономер 4) с катализатором Pd(0) в соответствии с реакцией, протекающей по следующей схеме.

,
Ar – – в соответствии с примером 1,

Предварительно осуществляют получение 1,3,5-три(п-фенилпинаколборат)бензола (мономер 4). 2. Растворяем 1,3,5-три(п-бромфенил)бензол (0,5г, 0,9208 ммоль) в перегнанном тетрагидрофуране (15 мл). 3. Добавляем катализатор - [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладий(2) комплекс с дихлорметаном (1/1) (0,1 мол %). Добавляем 4,4,5,5-тетраметил-1,3,2-диоксаборалан (2,7624 ммоль, 1 М, 3,3 мл ( с учётом 20% избытка). Раствор моментально становиться темно-вишнёвым. Затем добавляем основание (триэтиламин - 9 ммоль, 1,3мл). Происходит бурное выделение газа. Производим нагревание до 80
°С в течение 4-х часов. Образовавшийся осадок высаживаем в метанол, после чего фильтруем на мембранном фильтре.
В пробирку Шленка, продутую сухим аргоном, загружали исходные продукты токе аргона: 0,21 г (0,003 моль) мономера 4, 0,9 г (0,001656 моль) 1,3,5- три(п-бромофенил)бензола и 0.375 г (0,00135 моль) 4-бром-1,8-нафталевого ангидрида, добавили ДМФА и катализатор – тетра-кис-трифенилфосфин палладий, 25 мг тетрабутиламмоний хлористый, подогревали до полного растворения исходных веществ.
При слабом нагреве произошло растворение, а при увеличении температуры масса стала ярко – оранжевая. Реакционную массу нагревали до 80
оС и перемешивали при этой температуре в течение 2 часов.
Раствор высадили в метанол и образовавшийся осадок отфильтровали. Осадок промывали раствором HCl, водой, метанолом, и высушивали в вакуумном эксикаторе при комнатной температуре в течение 10 часов. Выход составил 60% (0,56 г).
Строение полученных полимеров было подтверждено с помощью модельных соединений. В качестве модельных соединений были изучены 1,3,5-трифенилбензол (3), 1,3,5-три(дифенилил)бензол (4) и тридекафенил (5). Как исходные, так и модельные соединения были получены циклотримеризацией соответствующих моноацетилароматических соединений в присутствии триэтилортоформиата и кислотного катализатора (газообразного HCl) по схеме:
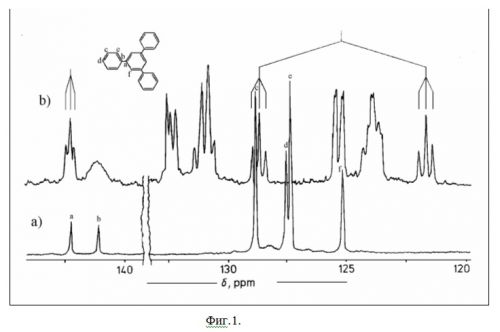
На фиг.1 показан спектр ЯМР13С (и 1Н) для соединения 3 – 1,3,5-трифенилбензол, с отнесением сигналов.
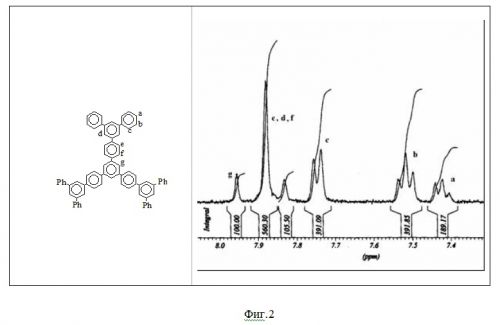
На фиг.2 показан спектр ПМР для соединения 5 – тридекафенил, с отнесением сигналов.
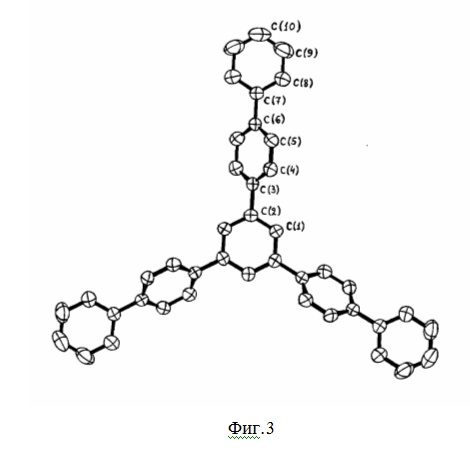
На фиг.3 представлен рентгеноструктурный анализ соединения 4.
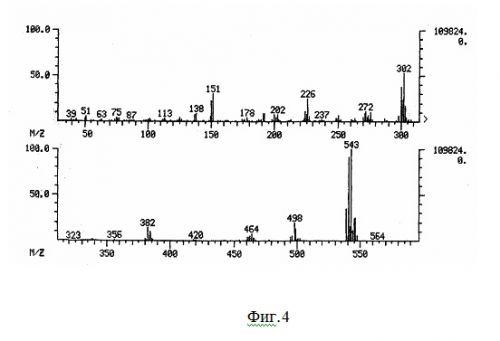
На фиг.4 показан масс-спектр соединения 1.
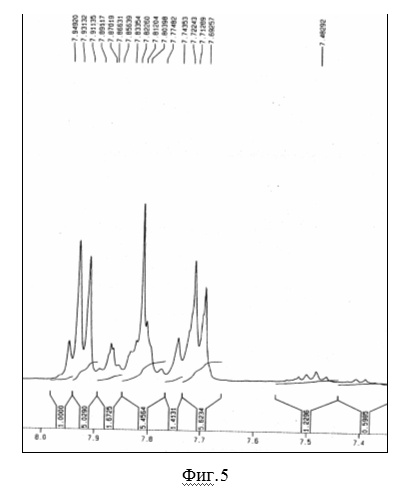
На фиг.5 показан ПМР спектр 1,3,5-три(4-пинаколборат-ил-фенил)бензола.
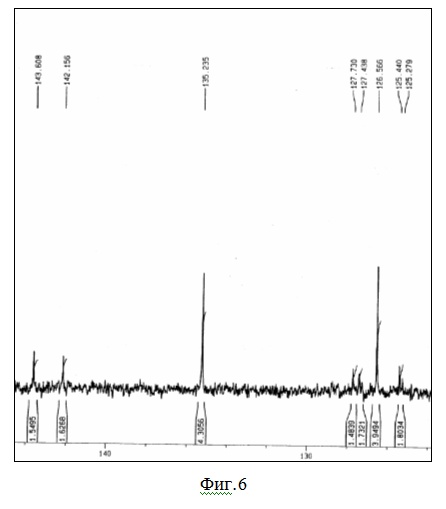
На фиг.6 представлен ЯМР13С спектр 1,3,5-три(4-пинаколборат-ил-фенил)бензола.
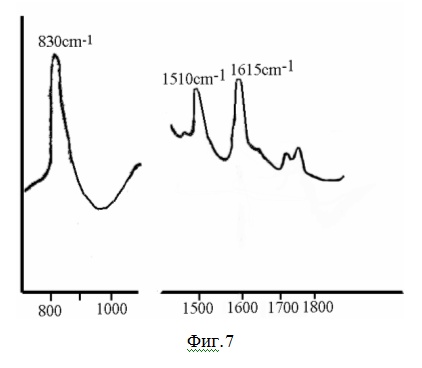
На фиг.7 показан ИК-спектр полимера с карбоксинафтильными группами.
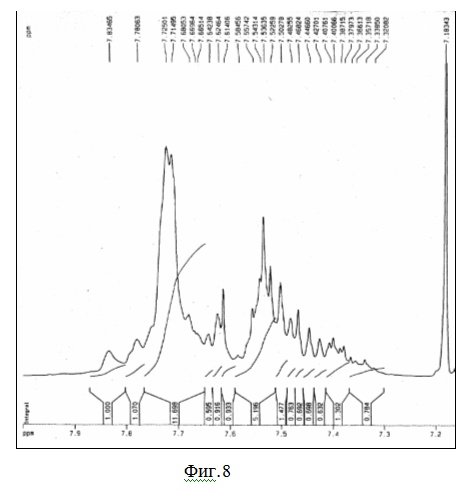
На фиг.8 показан ПМР спектр разветвленного полифенилена.
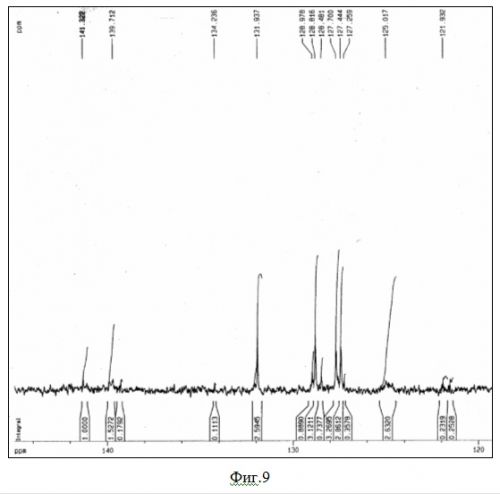
На фиг.9 представлен ЯМР 13C спектр полифенилена.
Были изучены ЯМР-спектры соединения 3, что позволило отнести сигналы основной ароматической структуры в полимерах. На фиг.1 показаны ЯМР
13С спектры 1,3,5-трифенилбензола (3); а)
13С – {
1H} спектр); b) спин-спиновое взаимодействие
13С –
1Н не скомпенсировано. Положения сигналов монозамещенных бензольных колец находятся в хорошем соответствии с положениями, приведенными в каталогах для бифенила. Два сигнала – "a" и "f" следует отнести к четвертичным и третичным атомам углерода 1,3,5-тризамещенного бензольного кольца, соответственно. Это подтверждается
13С-ЯМР спектром 3, в котором спин-спиновое взаимодействие 13С – 1Н не подавлено: сигнал третичных атомов углерода ("f") с константами спин-спинового взаимодействия 1J(
13С –
1Н) 157 Hz и 3J(13C – 1H) 6,2 Hz и сигнал четвертичного атома углерода (“a”) на триплет с константой 2J(13C – 1H) 3,4 Hz.
На фиг.2 представлен ПМР спектр тридекафенила (5) с отнесением сигналов. Положение сигналов и соотношение интегральных интенсивностей однозначно подтверждает строение этого соединения.
Строение соединения 4 подтверждено данными рентгеноструктурного анализа, представленного на фиг.3.
Длины связей центрального бензольного кольца молекулы 4 (1,395(3) Å) (фиг.3) соответствуют стандартной длине ароматической связи (1,394(5) Å). Однако в п-фениленовых фрагментах С-С связи уже слегка укорочены. Длины связи СPh – CPh равны 1,480 Å для 4. Эти величины близки по длине или чуть короче тех же связей в 1,3,5-трифенилбензоле (3) (1,487 Å).
Замечено, что длины связей в терминальных фенильных группах, также как и длины связей между терминальным ядром и предыдущим ядром несколько короче стандартных величин, вероятно благодаря термическому движению молекулы. Бензольные кольца в молекуле 4 планарны. Трифенилбензольный фрагмент, в соответствии с его 32-симметрией, имеет конформацию пропеллера. В целом, для молекулы 4 большинство длин связей и углов близко к их низкомолекулярным аналогам, т.е. геометрические параметры не изменяются с увеличением размера молекулы.
Таким образом, сравнение данных рентгеноструктурного анализа для циклотримеров 3 и 4 показало, что центральное 1,3,5-трифенилбензольное кольцо указанных соединений является достаточно планарным по отношению к соседним бензольным кольцам, а структура ветвей является рыхлой и допускает внедрение молекул включения.
Таким образом, наличие в циклотримерах 1,3,5-тризамещенного ядра доказано различными методами, в спектрах ЯМР произведено отнесение сигналов, которое позволяет отнести сигналы в спектрах полимеров и доказать их структуру.
Одним из исходных соединений для синтеза полифениленов служил 1,3,5-три(п-бромфенилил)бензол (1).
Масс-спектр соединения 1 приведен на фиг.4.
На фиг.5 и фиг.6 показаны ЯМР-спектры (
1Н и
13С соответственно), полностью подтверждающие строение исходного для реакций Сузуки соединения - 1,3,5-три(4-пинаколборат-ил-фенил)бензола, синтезированного из соединения 1, его взаимодействием с бис-пинаколборатом по Сузуки. Данные элементного анализа по бору полностью соответствуют расчетным данным.
Полифенилены были охарактеризованы элементным анализом. Для контроля содержания концевых групп брома проводили анализ на бром. Содержание брома составляло от 5 до 25%. Последнее значение соответствовало полимеру, который был получен только на основе три- и моно-функционального мономера. Более низкие значения брома получались при блокировании концевых групп дополнительной порцией монофункционального соединения. В полимерах с нафтилимидной, пиридильной и бипиридильной группами определяли содержание азота. Например, в полимере с нафтилимидной группой оно составляло 5,8% (расчет – 6,2%).
Полимер с карбоксинафтильными группами был исследован ИК- спектроскопией (фиг. 6).
На фиг.7 показан ИК-спектр полимера с карбоксинафтильными группами.
В спектре наблюдаются колебания при длине волн 830, 1500 и 1600 см
-1, что соответствует замещеному бензольному кольцу. Также присутствуют полосы при 1730 - 1770 см
-1, характеризующие ангидридную группу.
Были сняты ЯМР-спектры ряда полимеров. Наиболее характерные приведены на фиг. 8 и фиг.9.
В спектре ПМР (
1Н), дублет дублетов при 7,14 – 7-25 м.д. может быть отнесен к п-замещению бензольных колец. Синглет при 7,72 м.д. относится к 1,3,5-замещенному бензольному кольцу. Больше информации можно извлечь из спектра
13С ЯМР (фиг. 6).
Сигналы при 131,94 мд., а также при 128,5 - 129,0 м.д. можно отнести к атомам углерода бензольного кольца. Сигналы при 141,32 и 125,01 м.д.относятся к замещенному и незамещенному атому углерода бензольного кольца соответственно.
Были измерены молекулярные массы полимеров.
Средневесовые молекулярные массы Mw, определенные ГПХ с полистирольным стандартом, составляли от 1039 и до 1650 с коэффициентом полидисперсности 1,6 и 1,3 соответственно. Вероятно, для таких разветвленных полимеров только значения полидисперсности заслуживают доверия, тогда как абсолютные значения молекулярных масс могут очень сильно отличаться от истинных значений в связи с использованием полистирольных стандартов, не подходящих для данных полимеров. Определение молекулярной массы для полимеров методом седиментации в ультрацентрифуге дало Mw – от 5330 и до 8500.
Формула изобретения
1. Полифенилены общей формулы:
где
n – степень полимеризации от 5 до 20;
m = 1, 2;
q = 1, 2;
Ar – ариленовая группа, карбоксинафтильная группа, нафтилимидная, нафтильная, антраценовая группы, гетероциклическая группа, в том числе пиридильная и бипиридильная.
2. Способ получения полифениленов по п.1 включает проведение полимеробразующей реакции кросс-сочетания бром-замещенных ароматических или гетероароматических соединений или реакции бром-замещенных и борокси- или пинаколборат-замещенных ароматических или гетероароматических соединений в присутствии комплексов никеля или палладия, в которой в качестве исходных и одновременно разветвляющих мономеров применяются 1,3,5-три(п-бромфенил)бензол или 1,3,5-три(п-бромдифенил)бензол.
Реферат
Изобретение относится к химической и электронной отраслям промышленности, а конкретно к разветвленным полифениленам и способу их получения. Изобретение может быть использовано при производстве дисплеев, в электрофотографии, при изготовлении осветительных источников, фотодетекторов, сенсоров, полевых транзисторов, диодных лазеров и в других областях, когда необходимо обеспечить люминесценцию при преобразовании электрической энергии в световую. Используют полифенилены следующей общей формулы:

где n – степень полимеризации от 5 до 20; m = 1, 2; q = 1, 2; Ar – ариленовая группа, карбоксинафтильная группа, нафтилимидная, нафтильная, антраценовая группы, гетероциклическая группа, в том числе пиридильная и бипиридильная. Способ получения полифениленов указанной выше общей формулы заключается в проведении полимеробразующей реакции кросс-сочетания в присутствии комплексов никеля или палладия, а также бром- и/или борокси- замещенных ароматических и гетероароматических соединений, в которой в качестве разветвляющего мономера применяется 1,3,5-три(п-бромфенил)бензол, или 1,3,5-три(п-бромдифенил)бензол. 2 с.п.ф лы
 30+
30+

 ,
, ,
, ,
, ,
,
 ,
,
 ,
,
 ,
,